- Se incluyeron datos del primero y único estudio de fase 3 que evaluó en específico a un biológico en esta población difícil de tratar.
- El estudio de fase 3 demostró que más del doble de los pacientes tratados con Dupixent lograron aclaramiento o casi aclaramiento de la piel y cerca de cuatro veces más mejoras en el picor en comparación con placebo.
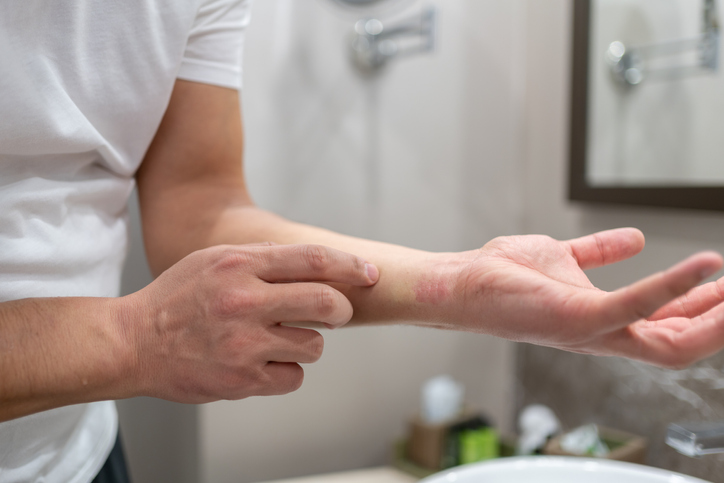
La Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos ha anunciado la actualización de la rotulación de Dupixent® (dupilumab) para incluir datos de eficacia y seguridad específicamente en pacientes de 12 años o más con dermatitis atópica y afectación no controlada de moderada a severa en manos y/o pies. Esta actualización se basa en los resultados del estudio de fase 3 LIBERTY-AD-HAFT, que evaluó por primera vez a un biológico en esta población difícil de tratar.
El estudio, que contó con la participación de 133 pacientes adultos y adolescentes con dermatitis atópica en manos y/o pies, demostró que el tratamiento con Dupixent proporcionó resultados significativos en comparación con el placebo. Después de 16 semanas, el 40% de los pacientes tratados con Dupixent lograron aclaramiento o casi aclaramiento de la piel en manos y pies, en comparación con el 17% en el grupo de placebo. Además, el 52% experimentó una reducción clínicamente significativa del picor en estas áreas, en comparación con el 14% en el grupo de placebo.
Naimish Patel, M.D., Director de Desarrollo Global, Inmunología e Inflamación de Sanofi, destacó la importancia de estos datos para los pacientes que sufren de dermatitis atópica en áreas cruciales como las manos y los pies. Patel señaló que el estudio aborda una población difícil de tratar y que la inclusión de estos datos en la rotulación de Dupixent proporciona a los médicos una herramienta adicional para abordar los desafíos asociados con esta forma específica de la enfermedad.
George D. Yancopoulos, M.D., Ph.D., Copresidente de la Junta, Presidente y Oficial Científico Principal de Regeneron, enfatizó la importancia de Dupixent como el primer biológico con datos específicos para esta subclasificación de la dermatitis atópica. Destacó que la aprobación inicial de Dupixent en 2017 ha permitido tratar a cientos de miles de pacientes con dermatitis atópica de moderada a severa en todo el mundo.
La actualización de la rotulación se basa en los resultados del estudio LIBERTY-AD-HAFT, un ensayo de fase 3 doble ciego y controlado con placebo. Los pacientes recibieron Dupixent cada dos semanas, y los resultados principales demostraron que más del doble de los pacientes tratados con Dupixent lograron aclaramiento o casi aclaramiento de la piel en manos y pies en comparación con el placebo.
Los resultados de seguridad fueron consistentes con el perfil conocido de seguridad de Dupixent en dermatitis atópica, con eventos adversos comunes como reacciones en el área de inyección, conjuntivitis, blefaritis y herpes oral.
Dupixent, un anticuerpo monoclonal que inhibe las vías de interleucina-4 (IL-4) e interleucina-13 (IL-13), ha demostrado beneficios clínicos significativos en diversas enfermedades relacionadas con la inflamación tipo 2, incluyendo dermatitis atópica, asma, rinosinusitis crónica con poliposis nasal (RSCcPN), esofagitis eosinofílica (EEo) y prurigo nodular.
Actualmente, Dupixent está aprobado en más de 60 países para tratar diversas indicaciones, y más de 800,000 pacientes en todo el mundo reciben tratamiento con este medicamento. Sanofi y Regeneron continúan evaluando el potencial uso de Dupixent en una variedad de enfermedades mediadas por inflamación tipo 2 en estudios de fase 3, lo que incluye EEo pediátrica, urticaria espontánea crónica, prurito crónico de origen desconocido, enfermedad pulmonar obstructiva crónica con evidencia de inflamación tipo 2 y penfigoide ampolloso.
Te puede interesar: Investigaciones prometedoras para el tratamiento de cánceres genitourinarios