Nuestro objetivo
En este espacio te brindamos todos los datos de los fármacos que fueron recetados o prescritos para tu condición. encontraras la información a cerca de posibles reacciones adversas, modos de uso y mucho más.
Nuestro objetivo
En este espacio te brindamos todos los datos de los fármacos que fueron recetados o prescritos para tu condición. encontraras la información a cerca de posibles reacciones adversas, modos de uso y mucho más.
Preguntas frecuentes
Son compuestos químicos que se utilizan para curar, detener, prevenir o para ayudar a diagnosticar algunas enfermedades. Algunos medicamentos se fabrican en laboratorios, otros se fabrican con organismos como los hongos y otros se obtienen a través de la ingeniería biológica.
La administración de un medicamento puede hacerse de una o varias formas, algunas de ellas son:
- Líquidos que se tragan
- Gotas que se aplican en las orejas o los ojos
- Cremas, geles o pomadas que se aplican sobre la piel
- Inhaladores
- Parches que se pegan sobre la piel
- Pastillas que se colocan debajo de la lengua (sublinguales)
- Inyecciones y medicamentos intravenosos (se insertan dentro de una vena)
Son efectos no deseados causados por medicamentos. La mayoría son leves, como dolor de estómago, boca seca o somnolencia. Otros pueden ser más graves y puede interactuar con una enfermedad que tiene y causar un efecto secundario.
Las alergias son un tipo de reacción y pueden variar de leves a potencialmente mortales. Las reacciones cutáneas, como urticaria y sarpullido, son el tipo más común. La anafilaxia es una reacción alérgica grave, pero menos común.
Asegúrate de preguntar al profesional de la salud o farmacéutico cómo tomar el medicamento correctamente. Ten en cuenta que otros medicamentos, alimentos y suplementos pueden afectar la efectividad del mismo. Háblalo con el especialista.
Notas
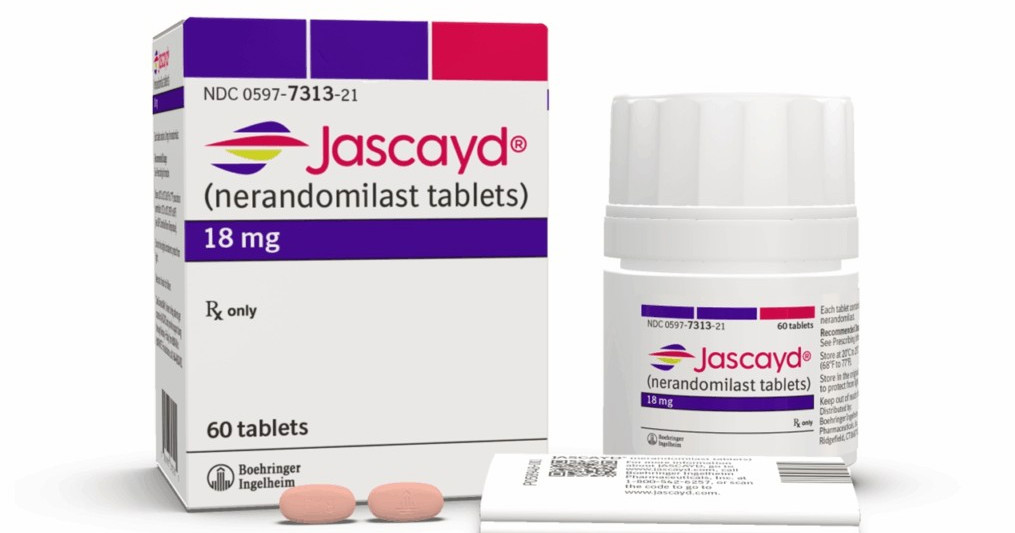
La FDA aprueba Jascayd, un nuevo fármaco para tratar la fibrosis pulmonar progresiva
23 de diciembre de 2025
No hay comentarios
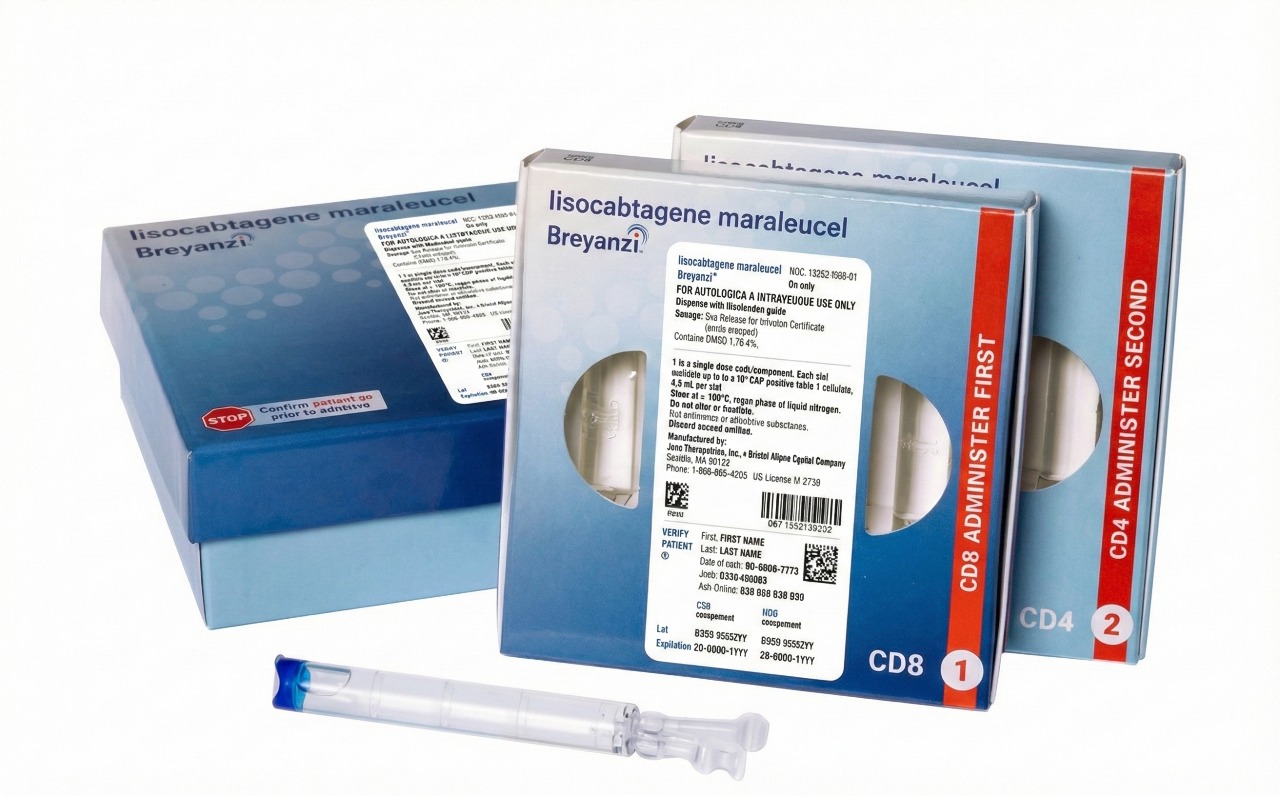
FDA aprueba nueva terapia para pacientes con linfoma poco común
11 de diciembre de 2025
No hay comentarios

¿PR preparadopara convertirse en un “Hub Farmacéutico” en 2026?
11 de diciembre de 2025
No hay comentarios
FDA aprueba uso ampliado de Jaypirca para tratar un tipo de cáncer de sangre en pacientes ya tratados
4 de diciembre de 2025
No hay comentarios

Puerto Rico clave en la producción del primer tratamiento oral para la obesidad y la diabetes tipo 2
30 de octubre de 2025
No hay comentarios
Aprueban primera terapia para niños con psoriasis y artritis psoriásica
22 de octubre de 2025
No hay comentarios
Multimedia
Playlist
7 Videos









